ICH 于 7 月 27 日正式發布了廣受期待的 Q13 《原料藥與制劑的連續制造》指南,公開征詢意見。指南“描述了連續制造(CM)的開發、實施、操作和生命周期管理的科學和監管考慮因素。”指南還“澄清了 CM 的概念,描述了科學方法,并提出了針對原料藥和制劑連續制造的監管考量。”
指南適用于化學實體和治療性蛋白質原料藥和制劑的連續制造。適用于新產品(例如,新藥、仿制藥和生物類似藥)的連續制造以及現有產品從批制造轉變為連續制造。另外,指南指出,指南中的原則也可能適用于其它生物/生物技術實體。
新發布的指南草案現已進入 ICH 流程的第 2 階段,在此階段,ICH 大會將向地區監管機構發布共識草案,以供內部咨詢和公眾評議。ICH Q13 由一個主體指南和五個附錄組成;指南討論了不同的連續制造模式,并審查了控制策略和監管考慮。
指南草案中描述了三種不同的連續制造模式:
制造方法的組合,其中一些單元操作以批處理模式運行,而其它單元操作則集成并以連續模式運行;
原料藥或制劑生產過程的所有單元操作被集成并以連續模式運行;
原料藥和制劑單元操作跨越原料藥和制劑之間的邊界集成形成單一連續制造過程(即,原料藥通過集成單元操作連續形成和加工以生成最終藥品制劑)。
指南中指出,在這三種連續制造模式下的任何一種制造方法都可以結合緩沖管線或儲罐,保持物料輸入和輸出的恒定流量。
指南的正文部分介紹了通常不特定于技術、劑型或分子類型的連續制造的基本方面。指南的五個附錄討論了原料藥、制劑、治療性蛋白原液以及原料藥和制劑集成的連續制造,并包含了一個有關管理干擾的觀點的附錄,通過提供特定于某些模式、技術和生產方法的說明性示例和考量因素,用以補充指南正文。
指南將 ICH Q7 的批次定義合并到連續制造中。一批被定義為由輸出物料的量、輸入物料的量或在定義的定義的質量流量下的運行時間組成。根據指南,其它“科學合理”的方法也被考慮用于定義批次。
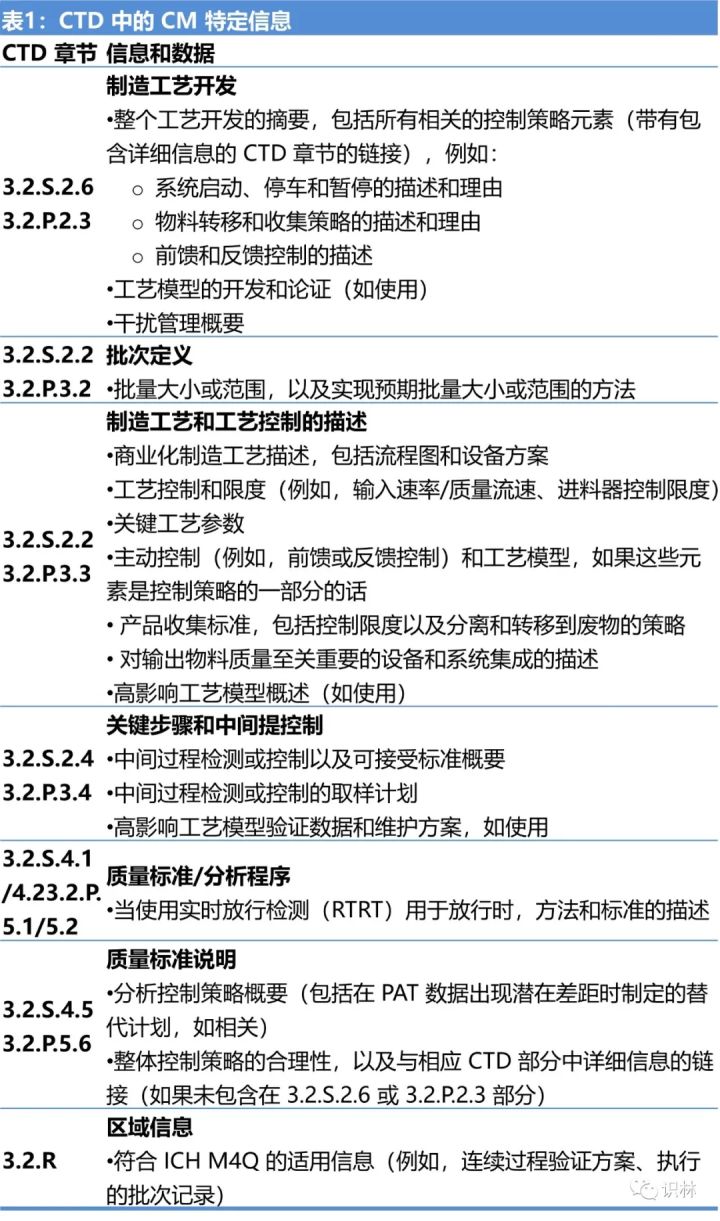
指南中還用專門的一節介紹了在通用技術文件(CTD)中如何提交關于連續制造的特定信息,見下表。在原料藥和制劑集成連續制造的情況下 , 一些信息和數據,例如集成流程圖可能會在 CTD 3.2.P 中提供,并在 3.2.S 中交叉引用。
ICH 專家工作組計劃于 2021 年 11 月舉行面對面會議 , 討論收到的反饋意見,并計劃于 2022 年 11 月簽署文件 , 將指南推進到第 3 階段,隨后采納實施指南。
作者:識林-藍杉
來源:識林